Termodinamik ve ısı transferi. Isı transferi ve hesaplama yöntemleri. Isı transferi ...
Bugün bu soruya bir cevap bulmaya çalışacağız"Isı transferi ...?" Yazıda sürecin ne olduğunu, doğada ne tür var olduğunu ve ısı transferi ile termodinamik arasındaki ilişkiyi öğreneceğiz.
tanım

Isı transferi fiziksel bir süreçtir, özdürtermal enerjinin transferinden oluşur. Değişim iki organ veya onların sistemi arasında gerçekleşir. Zorunlu koşul, daha ısıtılmış vücutlardan daha az ısıtılmış olanlara ısı transferi olacaktır.
Süreç özellikleri
Isı transferi - bu bir tür olgudur,Doğrudan temas ile ve bölünen bölümlerin varlığında meydana gelebilir. İlk durumda, her şey açıktır, ikinci durumda, gövdeler, materyaller ve medya engel olarak kullanılabilir. İki veya daha fazla cisimden oluşan bir sistemin termal denge durumunda olmadığı durumlarda ısı transferi gerçekleşecektir. Yani, nesnelerden biri diğerinden daha yüksek veya daha düşük bir sıcaklığa sahiptir. Daha sonra ısı enerjisi transferi gerçekleşir. Sistem termodinamik veya termal denge durumuna geldiğinde sona ereceğini varsaymak mantıklıdır. Süreç, termodinamiğin ikinci yasasını anlatabildiğimiz gibi, kendiliğinden oluşur.
türleri
Isı transferi, olabilecek bir süreçtir.üç şekilde ayrılmıştır. Bunlar temel bir yapıya sahip olacaklar, çünkü içlerinde kendi genel özellikleri olan, kendi özelliklerine sahip olan gerçek alt kategorileri tanımlamak mümkündür. Bugüne kadar, üç tip ısı transferini ayırt etmek yaygındır. Bu termal iletkenlik, konveksiyon ve radyasyon. İlk önce belki de başlayalım.
Isı transferinin yolları. Termal iletkenlik.

Bu birinin ya da diğerinin mülkiyetinin adıdır.enerji transferini taşımak için malzeme gövdesi. Bu durumda, daha ısıtılmış kısımdan daha soğuk olana aktarılır. Bu fenomenin merkezinde, moleküllerin kaotik hareket ilkesi yatmaktadır. Bu Brownian hareketi denir. Vücut ısısı ne kadar yüksek olursa, moleküller daha kinetik enerjiye sahip olduklarından daha aktif olurlar. Termal iletkenlik sürecinde elektronlar, moleküller ve atomlar katılır. Farklı bölümlerinde eşit olmayan bir sıcaklığa sahip olan vücutlarda gerçekleştirilir.
Madde ısıyı iletebilirse, biz yapabilirizniceliksel bir özellik varlığından bahseder. Bu durumda rol, termal iletkenlik katsayısı tarafından oynanır. Bu özellik, uzunluk birimi ve birim zaman birimi boyunca ne kadar ısı geçeceğini gösterir. Bu durumda, vücudun sıcaklığı tam olarak 1 K değişecektir.
Önceden, çeşitli ısı alışverişi olduğuna inanılıyordu.Gövdenin bir kısmından diğerine ısı denilen akıntıya bağlı olarak gövdeler (kapalı yapıların ısı transferi de dahil olmak üzere). Bununla birlikte, hiç kimse onun gerçek varoluşunun belirtilerini bulamadı ve moleküler-kinetik teori belli bir seviyeye geldiğinde, herkes hipotezi savunulamaz olduğu için ısıyı düşünmeyi unuttu.
Konveksiyon. Suyun ısı transferi

Bu ısı değişimi yöntemi altındaİç akışlar vasıtasıyla transfer anlamına gelir. Su ısıtıcısını hayal edelim. Bilindiği gibi, daha ısıtılmış hava akışları yukarı doğru yükselir. Ve soğuk, daha ağır, düşmek. Peki su neden farklı olmalı? Onunla kesinlikle aynı. Ve böyle bir döngü sürecinde, su katmanları, kaç tanesi olursa olsun, termal dengesinin başlangıcından önce ısınacaktır. Elbette, belirli koşullarda.
radyasyon
Bu yöntem prensipte oluşurelektromanyetik radyasyon. İç enerjiden kaynaklanıyor. Termal radyasyon teorisine girmeyeceğiz, sadece bunun sebebi, yüklü parçacıkların, atomların ve moleküllerin düzenlenmesidir.
Isı iletiminin basit problemleri
Şimdi pratikte nasıl göründüğünden bahsedelimısı transfer hesabı. Isı miktarı ile ilgili basit bir görevi çözelim. Yarım kilograma eşit bir su kütlesine sahip olduğumuzu varsayalım. Başlangıçtaki su sıcaklığı 0 santigrat derece, son sıcaklık 100'dür. Bu madde kütlesini ısıtmak için harcadığımız ısı miktarını bulalım.
Bunun için Q = cm formülüne ihtiyacımız var.2-t1), burada Q, ısı miktarıdır, c, suyun özgül ısısıdır, m, maddenin kütlesi, t1 - başlangıç, t2 Son sıcaklık. Su için c değeri tabulardır. Özel ısı kapasitesi 4200 J / kg * C olacaktır. Şimdi bu değerleri formülde yerine koyun. Isı miktarının 210000 J veya 210 kJ'ye eşit olacağını düşünelim.
Termodinamiğin birinci kanunu

Termodinamik ve ısı transferi birbiriyle ilişkilidirbazı yasalar. Sistem içindeki içsel enerjideki değişimlere iki şekilde ulaşılabildiği bilgisine dayanırlar. Birincisi mekanik işlerin komisyonu. İkincisi belli bir miktar ısı mesajıdır. Bu arada, bu ilke termodinamiğin birinci yasasına dayanmaktadır. Formülasyonu şöyle: Eğer sistem belli bir ısı derecesinden haberdar edilmişse, dış organlar üzerinde çalışmak veya iç enerjisini arttırmak için harcanacak. Matematiksel gösterim: dQ = dU + dA.
Artıları veya eksileri?
Kesinlikle içine giren tüm miktarlarTermodinamiğin birinci kanununun matematiksel kaydı, artı işareti veya eksi işareti ile yazılabilir. Ve bunların seçimi sürecin koşulları tarafından belirlenir. Sistemin belli bir miktarda ısı aldığını varsayalım. Bu durumda, içindeki bedenler ısıtılır. Sonuç olarak, bir gaz genleşmesi vardır, bu da işin yapıldığı anlamına gelir. Sonuç olarak, değerler olumlu olacaktır. Isı miktarı alınırsa, gaz soğur, iş onun üstünde yapılır. Değerler karşıt değerleri alacaktır.
Termodinamiğin birinci yasasının alternatif formülasyonu
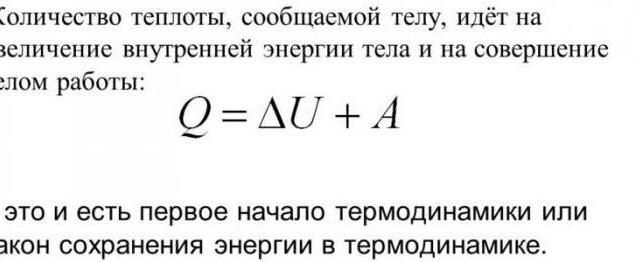
Farz edelim ki periyodik olarakaktif motor İçinde, çalışan beden (veya sistem) dairesel bir süreç gerçekleştirir. Genellikle döngü denir. Sonuç olarak, sistem orijinal durumuna geri dönecektir. Bu durumda iç enerjideki değişimin sıfır olacağını varsaymak mantıklı olacaktır. Isı miktarının mükemmel çalışmaya eşit olacağı ortaya çıkıyor. Bu hükümler, termodinamiğin birinci yasasını farklı bir şekilde formüle etmeyi mümkün kılar.
Ondan, doğada neyin olamayacağını anlayabiliriz.İlk türün sürekli hareket makinesi var. Yani, dışarıdan alınan enerjiye kıyasla daha fazla iş yapan bir cihaz. Bu durumda, eylemler periyodik olarak alınmalıdır.
İzoproseslerin termodinamiğin birinci kanunu
İlk önce izochoric süreci düşünelim. Bununla birlikte, ses sabit kalır. Yani, hacim değişikliği sıfır olacaktır. Sonuç olarak, iş aynı zamanda sıfır olacaktır. Bu terimi termodinamiğin birinci kanundan düşürüyoruz, daha sonra dQ = dU formülünü elde ediyoruz. Bu nedenle, izochoric işleminde, sisteme verilen tüm ısı, gazın veya karışımın iç enerjisini arttırır.
Şimdi izobarik süreç hakkında konuşalım. İçindeki sabit değer, basınç olarak kalır. Bu durumda, iç enerji çalışmaya paralel olarak değişecektir. İşte orijinal formülü: dQ = dU + pdV. Yapılan işi kolayca hesaplayabiliriz. UR ifadesine eşit olacaktır (T2-T1). Bu arada, bu evrensel gaz sabitinin fiziksel anlamıdır. Bir mol gazın ve bir Kelvin'in sıcaklık farkının varlığında, evrensel gaz sabiti, izobarik işlemde gerçekleştirilen işe eşit olacaktır.








